Перейти к:
Формирование рынка программных медицинских изделий в Российской Федерации в 2007–2024 гг.: практические результаты
https://doi.org/10.47093/2713-069X.2024.5.3.53-61
Аннотация
Согласно рекомендациям Международного форума регуляторов медицинских изделий (МИ), программное обеспечение (ПО), предназначенное для применения в медицинских целях, относится к категории МИ. За последние годы в России была проведена большая системная работа по выстраиванию нормативного регулирования и процессов контроля эффективности и безопасности ПО как МИ и его последующей государственной регистрации.
Цель. Анализ действующих процедур и результатов государственной регистрации ПО как МИ в Российской Федерации в 2007–2024 гг.
Материалы и методы. Был проведен систематический поиск сведений о зарегистрированном в России в качестве МИ ПО. Для этого использовался государственный реестр МИ Росздравнадзора. Были найдены 157 записей о регистрационных удостоверениях (РУ), выданных в период от 01. 01. 2007 до 30. 07. 2024.
Результаты. На радиологические информационные системы, включая системы архивирования изображений и связи (PACS-системы), было выдано 25,5 % РУ. На ПО как МИ, использующее технологии искусственного интеллекта, – 24,2 % РУ. На лабораторные информационные системы выдано 13,4 % РУ, а на медицинские информационные системы медицинских организаций – 4,5 %. На группу «Прочее ПО» пришлось 32,5 %, в нее были включены телемедицинские решения, ПО для планирования оперативных вмешательств и т. д. Более 50 % РУ на ПО как МИ выдано российским компаниям-разработчикам. Половина ПО как МИ зарегистрирована по 2а классу потенциального риска применения (50 %), на втором месте – класс 2б (17 %), на третьем – наименьший 1-й класс потенциального риска (18 %). Максимальный 3-й класс потенциального риска применения был определен у 15 % МИ, причем большая часть их – это ПО как МИ, использующее технологии искусственного интеллекта.
Заключение. В России выстроена и много лет уверенно работает система проведения независимых испытаний и государственной регистрации ПО как МИ, позволяющая производителям выводить на рынок самые разнообразные продукты, в том числе инновационные МИ, работающие с использованием технологий искусственного интеллекта. Российские компании-разработчики постепенно увеличивают долю рынка по сравнению с иностранными производителями.
Для цитирования:
Гусев А.В., Артемова О.Р., Андрейченко А.Е., Иванов И.В. Формирование рынка программных медицинских изделий в Российской Федерации в 2007–2024 гг.: практические результаты. Национальное здравоохранение. 2024;5(3):53-61. https://doi.org/10.47093/2713-069X.2024.5.3.53-61
For citation:
Gusev A.V., Artemova O.R., Andreychenko A.E., Ivanov I.V. Formation of the market of software medical devices in the Russian Federation in 2007–2024: Practical results. National Health Care (Russia). 2024;5(3):53-61. (In Russ.) https://doi.org/10.47093/2713-069X.2024.5.3.53-61
Цифровая трансформация здравоохранения является одним из наиболее важных направлений отраслевого развития в большинстве стран мира, включая Россию [1–3]. Широкое внедрение в практическое здравоохранение таких технологий, как электронные медицинские карты, телемедицина, искусственный интеллект (ИИ), удаленный мониторинг и т.д., имеет большие перспективы для достижения стратегических целей, включая сокращение предотвратимой заболеваемости и смертности, повышение эффективности использования ресурсов [4].
Одним из важнейших направлений цифровой трансформации является повышение эффективности работы врачей и среднего медперсонала, которое достигается путем внедрения различного программного обеспечения (ПО) и автоматизации лечебно-диагностических процессов. Международный форум регуляторов медицинских изделий (МИ) (International Medical Device Regulators Forum, IMDRF) считает такое ПО одним из видов МИ, выделяя его в отдельный класс для регулирования – «Программное обеспечение как медицинское изделие» (Software as a Medical Device, SaMD)1,2.
Основываясь на разработанных в IMDRF принципах и методических рекомендациях, большинство стран мира привели свое нормативное регулирование к единому подходу, который подразумевает обязательный государственный контроль ПО как МИ, включая независимую оценку эффективности и безопасности таких продуктов, прежде чем они получат официальное разрешение на выход на рынок.
В России в течение 2018–2022 гг. Министерство здравоохранения Российской Федерации совместно с Федеральной службой по надзору в сфере здравоохранения (Росздравнадзором) и профессиональным сообществом также провели большую работу по точечному изменению законодательства, что позволило упростить и стандартизировать регистрацию ПО в качестве МИ, в том числе создало правовые возможности вывода на рынок решений, использующих технологии ИИ [5].
Основу регулирования ПО как МИ составляет статья 38 Федерального закона 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации», которая определяет термин «медицинское изделие», включая возможность считать МИ специальное ПО3.
Государственная регистрация ПО как МИ, а также контроль за его обращением на территории Российской Федерации осуществляются Росздравнадзором. Основные правила и порядок государственной регистрации ПО как МИ определены постановлением Правительства РФ № 1416 от 27.12.20124.
Учитывая специфику разработки и обновления ПО как МИ, которое в отличие от традиционных аппаратных решений может создаваться в сжатые сроки и является нематериальным продуктом, в России была предусмотрена ускоренная процедура вывода таких решений на рынок. Для этого было выпущено постановление Правительства РФ № 633 от 31.05.20185, которым определено одноэтапное проведение экспертизы поданного разработчиком комплекта регистрационных документов, занимающее 20 рабочих дней.
Для того чтобы разработчики, организаторы здравоохранения, а также специалисты надзорных и экспертных организаций могли определить, относится ли тот или иной продукт к категории ПО как МИ, Росздравнадзор выпустил специальное письмо № 02И-297/20 от 13.02.20206, в котором привел соответствующие критерии и примеры их использования. Главными критериями, отличающими ПО как МИ от обычного ПО, являются предназначение, заявленное производителем, и результат обработки данных. Если созданное ПО предназначено для применения при оказании медицинской помощи и, что самое важное, в ходе обработки полученных им данных с помощью различных алгоритмов генерируется новая клинически значимая информация, то такое ПО однозначно относится к категории МИ. Если же ПО не предназначено для использования в медицинских целях или оно существенно не видоизменяет поданные данные, а, например, только сохраняет их в своих базах данных или передает по каналам связи, то такое ПО может не относиться к МИ, а значит, может быть выпущено на рынок без предварительного прохождения государственной регистрации.
В России законодательно запрещен оборот незарегистрированного ПО как МИ, включая его продажу и закупку, продвижение, сопровождение и в конечном итоге применение медицинскими работниками. Действующим законодательством предусмотрены наказания для компаний и организаций, допустивших нарушения этого требования, включая административную (статья 6.28 кодекса административных правонарушений7) и уголовную ответственность (статья 238.1 уголовного кодекса8).
Для того чтобы пройти государственную регистрацию, компания-разработчик ПО как МИ должна подготовить исчерпывающий комплект документов, который называется «Регистрационное досье». В него включаются «Технические условия», скриншоты ПО и другие документы, раскрывающие процессы проектирования и создания продукта. Ключевыми документами, входящими в комплект регистрационного досье, являются результаты независимых технических и клинических испытаний, которые должны быть проведены в уполномоченных Росздравнадзором организациях.
Требования к процедурам и порядку проведения технических и клинических испытаний определены приказом Минздрава № 2н от 09.01.20149. В ходе технических испытаний осуществляется проверка соответствия ПО как МИ установленным требованиям, включая нормативно-правовые акты, технические стандарты, а также технической и эксплуатационной документации, разработанной производителем. Целью проведения клинических испытаний является сбор убедительных и достаточных данных о клинической эффективности и безопасности применения ПО при оказании медицинской помощи. В ходе проведения таких испытаний эксперты должны собрать и систематизировать доказательства, что в случае применения медицинскими работниками данного продукта это не приведет к повышению риска причинения вреда здоровью пациента, например из-за возможных ошибок или низкого качества работы, но вместе с этим положительно повлияет на какие-либо результаты оказания медицинской помощи.
Как правило, клинические испытания ПО как МИ проводятся в виде ретроспективного исследования на основе данных, без участия пациентов. Для этого соответствующая медицинская организация заранее подготавливает эталонные наборы данных, которые подаются на вход в испытуемое ПО, затем результаты его работы фиксируются, сравниваются с эталонными значениями и формируются данные о точности, чувствительности и специфичности работы ПО на предоставленных данных. Эксперты сравнивают полученные данные с заявленными производителями характеристиками, оценивают приемлемость полученных данных с точки зрения применения продукта в условиях реальной клинической практики. Порядок, объемы эталонных данных, дизайн испытания и другие характеристики указываются в заранее разрабатываемом документе «Программа клинических испытаний», который также является важной частью регистрационного досье.
Если в ходе клинических испытаний необходимых данных о безопасности и эффективности ПО как МИ не удается получить или если будут выявлены критические несоответствия или ошибки, то такой результат испытаний указывает на высокий риск того, что использование продукта может приводить к реальной угрозе жизни и здоровью пациентов. В этом случае по такому ПО выносится решение об отрицательном результате испытаний и, соответственно, невозможности его государственной регистрации и вывода на рынок.
Порядок проведения испытаний, а также ряд отдельных требований к процедурам государственной регистрации зависят от класса потенциального риска применения. Для его определения используется номенклатурная классификация медицинских изделий, установленная приказом Минздрава РФ № 4н от 06.06.201210. Предусмотрено 4 класса риска: 1, 2а, 2б и 3. Если при разработке или функционировании МИ используются технологии ИИ, то такое МИ относятся к 3-му, максимальному классу потенциального риска.
В случае успешного прохождения технических и клинических испытаний компания-разработчик подает созданный комплект документов для экспертизы в Росздравнадзор. Порядок рассмотрения регистрационного досье определен приказом Минздрава РФ № 1353н от 21.12.201211, а также решением Совета Евразийской экономической комиссии № 46 от 12.02.201612. При проведении экспертизы соответствующие специалисты формируют свои решения на основе утвержденных методических рекомендаций, а также ряда специальных документов и национальных ГОСТов, которые периодически обновляются экспертными организациями.
Конечным итогом государственной регистрации ПО как МИ является выдача Росздравнадзором компании-разработчику регистрационного удостоверения (РУ) на МИ. Сведения о выданных РУ размещаются в Государственном реестре МИ и организаций (индивидуальных предпринимателей), осуществляющих производство и изготовление МИ (государственный реестр медизделий), информация из которого предоставляется в открытом доступе по адресу: http://www.roszdravnadzor.ru/services/misearch.
В соответствии с Решением Евразийской экономической комиссии № 174 от 22.12.201513 для всего ПО как МИ, выпущенного на рынок, осуществляется мониторинг безопасности. В России порядок его проведения определен приказом Минздрава № 980н от 15.09.202014. Целью данной нормы является выявление и предотвращение неблагоприятных событий, связанных с применением ПО как МИ. Фактически процесс мониторинга представляет собой сбор сведений о неблагоприятных событиях и их регистрацию в специальной информационной системе Росздравнадзора. Накопленные данные мониторинга используются специалистами надзорного ведомства для анализа, проведения экспертизы и при необходимости – контрольных мероприятий, конечной целью которых является профилактика повторения негативных событий, связанных с ПО как МИ, в будущем. Источником сбора сведений могут быть сообщения пользователей соответствующих продуктов, отчеты разработчиков, а также иные данные, поступающие во время их присутствия на рынке.
В настоящее время проведение технических и клинических испытаний, а также государственная регистрация ПО как МИ осуществляются по национальным правилам. Начиная с 2026 г. Россия перейдет на регистрацию ПО как МИ по единым правилам Евразийского экономического союза (ЕАЭС) [7].
Целью данной работы стал анализ государственной регистрации ПО как МИ в Российской Федерации в 2007–2024 гг.
МАТЕРИАЛЫ И МЕТОДЫ
Стратегия поиска данных
Был проведен систематический поиск сведений о зарегистрированных МИ в виде ПО, используя государственный реестр медизделий. Поиск проводился двумя авторами с использованием следующих поисковых запросов: «Обеспечение программное», «Программное обеспечение», «Система программного обеспечения», «Комплекс программный», «Программный модуль», «Программа автоматизированного анализа», «Система поддержки принятия решений», «Сервис поддержки принятия», «Медицинская информационная система». Найденные по поисковым запросам записи были выгружены в XLS-файл, в котором затем они были просмотрены на предмет соответствия цели исследования. Записи, не имеющие отношения к ПО как МИ, были удалены из материалов исследования. Также были исключены записи о регистрации аппаратных комплексов, медицинского оборудования, включавших в свой состав ПО, так как такие решения не были созданы именно как ПО, а лишь использовали программные наработки для своего функционирования.
Извлечение данных
В результате поиска и отбора были найдены 157 записей о РУ, выданных Росздравнадзором для ПО как МИ в период от 01.01.2007 до 30.07.2024. Далее путем поиска по номеру РУ в государственном реестре был получен доступ к детальной информации о МИ. Из государственного реестра были извлечены 11 признаков, характеризующих МИ, включая группу МИ, дату государственной регистрации, номер реестровой записи, регистрационный номер, наименование МИ, наименование организации-производителя и ее адрес, страна-происхождение организации-производителя, коды ОКП/ОКПД2, класс потенциального риска применения МИ и вид МИ. Дополнительно были проанализированы доступные в государственном реестре документы на зарегистрированное ПО как МИ для определения – к какому виду ПО относится каждый продукт, а также были ли в данном ПО использованы технологии ИИ.
Анализ данных
В исследовании применены аналитические методы анализа и синтеза. Использованы средства описательной статистики. Для сбора и обработки использовано ПО «Microsoft Excel» (Microsoft, США).
РЕЗУЛЬТАТЫ
За 17 полных лет (с 2007 по 2023 г.) и 7 месяцев 2024 г. Росздравнадзором было выдано 157 РУ на ПО как МИ, причем 61,2 % из них были выданы за последние 5 лет (рис. 1).
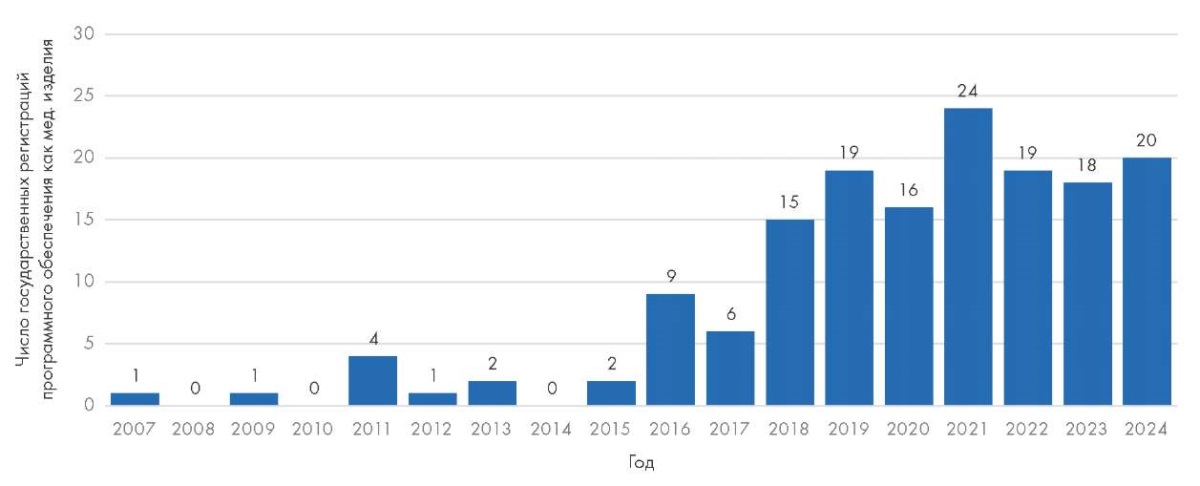
Рис. 1. Динамика регистрации программного обеспечения как медицинского изделия в Российской Федерации в 2007–2024 гг.
Fig. 1. Dynamics of registration of software as a medical device in the Russian Federation in 2007–2024
Обращает внимание, что с нормативной точки зрения до 01.01.2012 ПО не входило в определение «медицинского изделия», тем не менее до 2012 г. было выдано 6 РУ на ПО как МИ. Затем, несмотря на законодательное включение специального ПО в определение МИ, с 2012 по 2015 г. регистрация ПО в качестве МИ носила эпизодический характер – за это время было выдано 5 РУ на такие продукты. Начиная с 2016 г. отмечен рост числа РУ, выдаваемых Росздравнадзором на ПО как МИ, причем пик этой деятельности пришелся на 2021–2024 гг., вероятнее всего, благодаря активной деятельности рабочей группы Росздравнадзора, которая внесла множество изменений в нормативное регулирование, упростив и упорядочив процессы регистрации ПО как МИ и тем самым выступив драйвером процессов регистрации.
Радиологические информационные системы, включая системы архивирования изображений и связи (PACS-системы), составляют самую большую группу среди ПО как МИ – на такие продукты пришлось 25,5 % РУ. Второе место занимает ПО как МИ, использующее технологии ИИ (24,2 %). На третьем месте – лабораторные информационные системы, составляющие 13,4 % от всего зарегистрированного ПО как МИ. На четвертом месте – медицинские информационные системы медицинских организаций – 4,5 %. На группу «Прочее ПО» пришлось 32,5 %, в нее были включены телемедицинские решения, ПО для планирования оперативных вмешательств и т.д. (рис. 2).
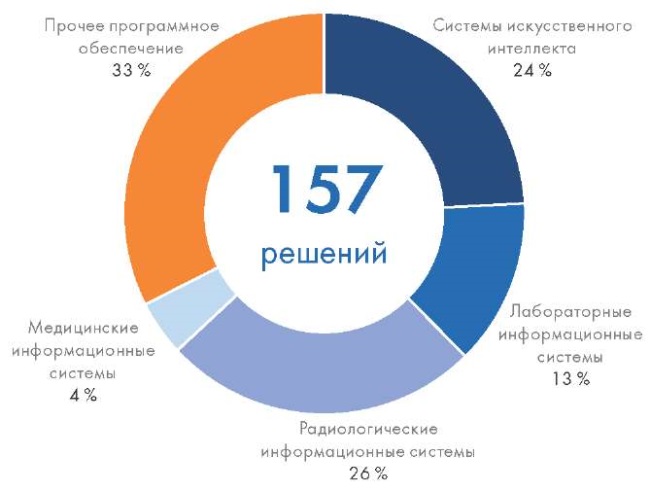
Рис. 2. Зарегистрированное Росздравнадзором программное обеспечение как медицинское изделие в 2007–2024 гг. по группам продуктов
Fig. 2. Software registered by Roszdravnadzor as software as a medical device in 2007–2024 by product groups
Интересно отметить, что в 2012 г., когда начала действовать законодательная норма, по которой ПО, предназначенное для применения при оказании медицинской помощи, было отнесено к понятию МИ, в России на рынке медицинского ПО присутствовало 89 компаний-разработчиков, преимущественно российской юрисдикции. Не менее 50 % из них выпускали на рынок медицинские информационные системы медицинских организаций. После выпуска письма Росздравнадзора от 13.02.2020 № 02И-297/20 и уточнения правил отнесения ПО к МИ регистрация этих медицинских информационных систем как МИ прекратилась – такое ПО, если оно не осуществляет интерпретацию медицинских данных и не использует технологии ИИ, было исключено из понятия «медицинское изделие».
Другой интересный тренд, выявленный нами в ходе исследования, относится к регистрации ПО как МИ, использующего технологии ИИ. На фоне утверждения в конце 2019 г. национальной стратегии развития ИИ15 активизировалась деятельность компаний-разработчиков по выпуску на рынок ПО с технологиями ИИ. Бóльшая часть таких продуктов была предназначена для применения в процессах оказания медицинской помощи. В отличие от разработчиков медицинских информационных систем медицинских организаций, которые несколько лет игнорировали законодательные требования, разработчики ИИ-систем фактически сразу поддержали норму закона и до начала продаж и внедрения своих продуктов стали проходить процедуры технических и клинических испытаний своих решений и в итоге получать РУ Росздравнадзора на ПО как МИ. К 01.08.2024 в России было выдано 36 РУ на такое ПО, причем 14 % из них были выданы иностранным компаниям-разработчикам. Подавляющее большинство ПО как МИ, использующего технологии ИИ, создано для автоматизации обработки медицинских изображений (87 %), остальное предназначено для анализа электронных медицинских карт (13 %).
Более 50 % регистрационных удостоверений на ПО как МИ выдано российским компаниям-разработчикам (рис. 3), при этом соотношение доли РУ, выданных российским и международным компаниям, изменялось за последнее время. Первоначально, с момента запуска программ импортозамещения в России в 2014 г., российские компании имели меньшее число выданных РУ по сравнению с иностранными: в 2016 г. 22 % у российских разработчиков против 78 % у иностранных. Затем ситуация постепенно, но неизменно менялась: в 2017 соотношение было 50 % на 50 %, в 2019 г. 53 % против 47 %, в 2018 г. 60 % РУ было выдано российским компаниям, в 2020 – 75 %. Таким образом видно, что постепенно российские производители отвоевывают свою долю рынка у иностранных разработчиков и, вероятнее всего, этот тренд сохранится в ближайшие годы.
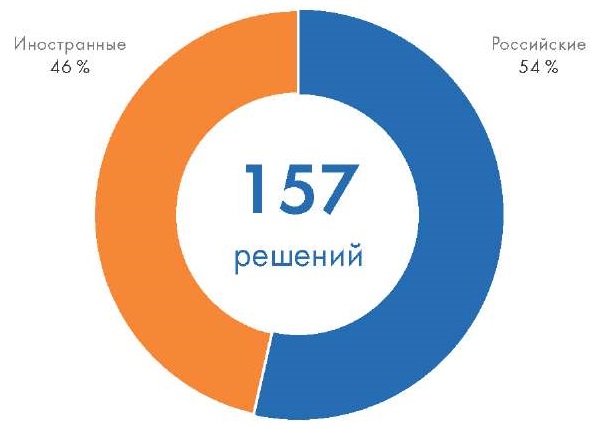
Рис. 3. Зарегистрированное Росздравнадзором программное обеспечение как медицинское изделие в 2007–2024 гг. по стране происхождения организации-производителя
Fig. 3. Software registered by Roszdravnadzor as software as a medical device in 2007–2024 by the country of origin of the medical device manufacturer
Половина ПО как МИ зарегистрирована по 2а классу потенциального риска применения, второе и третье места разделили класс 2б и наименьший 1‑й класс потенциального риска (по 17 %). Максимальный 3‑й класс потенциального риска применения был определен у 16 % МИ, причем бóльшая часть МИ с таким классом – это ПО как МИ, использующее технологии ИИ (рис. 4).
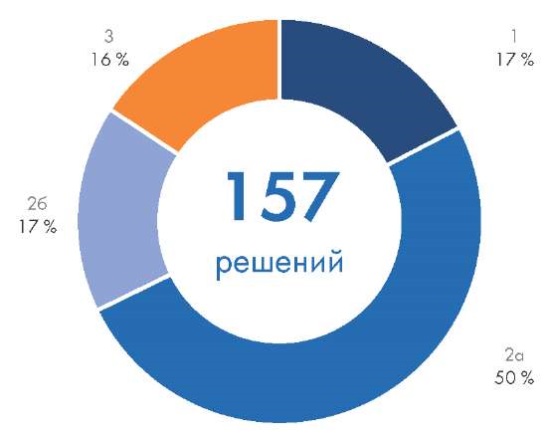
Рис. 4. Зарегистрированное Росздравнадзором программное обеспечение как медицинское изделие в 2007–2024 гг. по классу потенциального риска применения
Fig. 4. Software registered by Roszdravnadzor as software as a medical device in 2007–2024 by class of potential risk of use
ОБСУЖДЕНИЕ
Полученные в ходе исследования результаты наглядно подтверждают, что в целом в России выстроена система нормативно-правового и технического регулирования, позволяющая обеспечить прозрачный контроль за безопасностью и эффективностью ПО, предназначенного компаниями-разработчиками для применения при оказании медицинской помощи. За период с 01.01.2007 по 30.07.2024 на российский рынок было выведено 157 программных МИ, что не просто покрывает потребность отрасли в соответствующих программных продуктах, но и создает необходимые условия для конкуренции. Количество новых государственных регистраций ПО как МИ в целом выровнялось и за последние 4 года находится на стабильном уровне, причем российские компании-разработчики постепенно увеличивают свое доминирование на российском рынке, отвоевывая занимаемую долю у иностранных производителей.
До 2017 г. ни один из производителей медицинских информационных систем не осуществлял их государственную регистрацию, хотя в 2017 г. уже 37 % государственных и муниципальных медицинских организаций внедрили и использовали такое ПО [6]. За 2017–2021 гг. было выдано 7 РУ на медицинские информационные системы медицинских организаций как ИМ, все – российским компаниям-разработчикам; 6 из них имели класс потенциального риска применения 2а16.
Активно развивается сектор ПО как МИ, использующего технологии ИИ. В этом направлении Россия не просто внесла точечные изменения в нормативно-правовое регулирование, но и обогнала по нему многие страны – члены IMDRF, разработав и продолжая развивать комплекс национальных технических стандартов и методических документов [7][8]. Благодаря этому в России идет масштабное внедрение МИ, работающих с использованием ИИ.
В последнее время направление генеративного ИИ, в особенности большие языковые модели (large language model, LLM), развивается ускоренными темпами [9]. С точки зрения регистрации ПО как МИ это создает новые вызовы, так как программные решения на основе таких технологий начинают все больше создаваться не для интерпретации медицинских данных и применения в рамках лечебно-диагностического процесса медицинскими работниками, а для цифровой трансформации коммуникации между пациентом и врачом, а в некоторых случаях – исключительно для применения самими пациентами. С точки зрения действующего законодательства такое ПО не относится к категории МИ. Вместе с этим соединение возможностей генеративного ИИ и классического машинного обучения позволяют таким решениям предоставлять пациентам расширенный перечень функций: сбор и анализ медицинских данных, включая жалобы и данные с носимых медицинских устройств, постановку диагноза, формирование рекомендаций, в том числе по лечению. Возможности LLM позволяют имитировать общение пациента с цифровыми ассистентами на уровне, не отличимом от уровня общения пациента с реальным врачом. Все это вместе создает новые риски, что в случае некачественной реализации или отсутствия независимой внешней клинической валидации такие решения будут представлять высокий риск причинения вреда здоровью пациентам, но оставаться вне регуляторного поля. В этой связи целесообразно рассмотреть вопрос о внесении решений, использующих технологии генеративного ИИ и предназначенные для пациентов, в критерии отнесения к МИ.
ЗАКЛЮЧЕНИЕ
В последние годы Министерством здравоохранения и Росздравнадзором была проведена большая работа по внесению изменений в нормативно-правовое регулирование, что позволяет выводить на рынок ПО как МИ, на основе подходов и методических рекомендаций IMDRF.
В России сформирован и активно развивается соответствующий рынок, что создает для медицинских организаций довольно большой вариант выбора зарегистрированного ПО как МИ, прошедшего процедуры независимой проверки эффективности и безопасности, что является крайне важным с точки зрения не только цифровой трансформации российского здравоохранения, но и обеспечения необходимого уровня безопасности и качества реализации проектов внедрения цифровых инноваций.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Conflict of interests. The authors declare that there is no conflict of interests.
Финансирование. Исследование не имело спонсорской поддержки (собственные ресурсы).
Financial support. The study was not sponsored (own resources).
ВКЛАД АВТОРОВ
А.В. Гусев, О.Р. Артемова – концепция и дизайн исследования, обсуждение результатов, редактирование статьи.
А.Е. Андрейченко, И.В. Иванов – сбор и анализ материала исследования, написание текста.
Все авторы утвердили окончательную версию статьи.
AUTHOR CONTRIBUTIONS
Aleksandr V. Gusev, Oliya R. Artemova – concept and design of the study, discussion of results, editing the article.
Anna E. Andreychenko, Igor V. Ivanov – collection and analysis of the study material, writing text.
All the authors approved the final version of the article.
1. Software as a Medical Device (SaMD): Key Definitions. IMDRF/SaMD WG/N10. 2013. URL: http://www.imdrf.org/docs/imdrf/final/technical/imdrf-tech-131209-samd-key-definitions-140901.pdf (дата обращения: 30.08.2024).
2. Handbook of Artificial Intelligence in Healthcare. Intelligent Systems Reference Library. 2022; 212. Springer, Cham. URL: https://doi.org/10.1007/978-3-030-83620-7_11 (дата обращения: 30.08.2024).
3. Федеральный закон от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» (с изменениями и дополнениями). URL: http://base.garant.ru/57499516 (дата обращения: 30.08.2024).
4. Постановление Правительства РФ от 27 декабря 2012 г. № 1416 «Об утверждении Правил государственной регистрации медицинских изделий» (с изменениями и дополнениями). URL: https://base.garant.ru/70291692/ (дата обращения: 30.08.2024).
5. Постановление Правительства РФ от 31 мая 2018 г. № 633 «О внесении изменений в Правила государственной регистрации медицинских изделий». URL: https://base.garant.ru/71959186/ (дата обращения: 30.08.2024).
6. Письмо Федеральной службы по надзору в сфере здравоохранения от 13 февраля 2020 г. № 02И-297/20 «О программном обеспечении». URL: https://www.garant.ru/products/ipo/prime/doc/73467702/ (дата обращения: 30.08.2024).
7. Кодекс Российской Федерации об административных правонарушениях от 30.12.2001 № 195-ФЗ. URL: https://www.consultant.ru/document/cons_doc_LAW_34661/1754554e26a28a50d951d61eac0ed3628618fadf/ (дата обращения: 30.08.2024).
8. Уголовный кодекс Российской Федерации от 13.06.1996 № 63-ФЗ. Статья 238.1. Обращение фальсифицированных, недоброкачественных и незарегистрированных лекарственных средств, медицинских изделий и оборот фальсифицированных биологически активных добавок. URL: https://www.consultant.ru/document/cons_doc_LAW_10699/cc19b92bd79a2600eaeb4aab69468fb9471babd1/ (дата обращения: 30.08.2024).
9. Приказ Министерства здравоохранения РФ от 9 января 2014 г. № 2н «Об утверждении Порядка проведения оценки соответствия медицинских изделий в форме технических испытаний, токсикологических исследований, клинических испытаний в целях государственной регистрации медицинских изделий». URL: https://www.garant.ru/products/ipo/prime/doc/70531448/ (дата обращения: 30.08.2024).
10. Приказ Министерства здравоохранения РФ от 6 июня 2012 № 4н «Об утверждении номенклатурной классификации медицинских изделий» (с изменениями и дополнениями). URL: https://base.garant.ru/70199586/ (дата обращения: 30.08.2024).
11. Приказ Министерства здравоохранения РФ от 21 декабря 2012 № 1353н «Об утверждении Порядка организации и проведения экспертизы качества, эффективности и безопасности медицинских изделий». URL: https://base.garant.ru/57507223/ (дата обращения: 30.08.2024).
12. Решение Совета Евразийской экономической комиссии от 12 февраля 2016 г. № 46 «О Правилах регистрации и экспертизы безопасности, качества и эффективности медицинских изделий». URL: https://docs.eaeunion.org/docs/ru-ru/01510767/cncd_12072016_46 (дата обращения: 30.08.2024).
13. Решение Совета Евразийской экономической комиссии от 22 декабря 2015 г. № 174 «Об утверждении Правил проведения мониторинга безопасности, качества и эффективности медицинских изделий». URL: https://docs.eaeunion.org/docs/ru-ru/0159291/clcd_30122015_174 (дата обращения: 30.08.2024).
14. Приказ Министерства здравоохранения РФ от 15 сентября 2020 г. № 980н «Об утверждении Порядка осуществления мониторинга безопасности медицинских изделий». URL: https://base.garant.ru/74848249/ (дата обращения: 30.08.2024).
15. Указ Президента Российской Федерации от 10.10.2019 № 490 «О развитии искусственного интеллекта в Российской Федерации». URL: http://publication.pravo.gov.ru/Document/View/0001201910110003 (дата обращения: 30.08.2024).
16. Приказ Министерства здравоохранения РФ от 6 июня 2012 г. № 4н «Об утверждении номенклатурной классификации медицинских изделий» (с изменениями и дополнениями). URL.: https://base.garant.ru/70199586/ (дата обращения: 30.08.2024).
Список литературы
1. Серрато П., Халамка Д. Цифровая трансформация здравоохранения. Переход от традиционной к виртуальной медицинской помощи. М.: «ГЭОТАР-Медиа», 2022. 192 с. ISBN: 978-5-9704-7007-7
2. Пугачев П.С., Гусев А.В., Кобякова О.С. и др. Мировые тренды цифровой трансформации отрасли здравоохранения. Национальное здравоохранение. 2021; 2(2): 5–12. doi: 10.47093/2713-069X.2021.2.2.5-12
3. Карпов О.Э., Субботин С.А., Шишканов Д.В., Замятин М.Н. Цифровое здравоохранение. Необходимость и предпосылки. Врач и информационные технологии. 2017; 3: 6–22. EDN: ZGYVMB
4. Borges do Nascimento I.J., Azzopardi-Muscat N., Zapata T., et al. The global effect of digital health technologies on health workers, competencies and health workplace: an umbrella review of systematic reviews and lexical-based and sentence-based meta-analysis. The Lancet Digital Health. 2023; 5(8): E534–E544. doi: 10.1016/S2589-7500(23)00092-4
5. Гусев А.В., Морозов С.П., Кутичев В.А., Новицкий Р.Э. Нормативно-правовое регулирование программного обеспечения для здравоохранения, созданного с применением технологий искусственного интеллекта, в Российской Федерации. Медицинские технологии. Оценка и выбор. 2021; 1: 36–45. doi: 10.17116/medtech20214301136
6. Гусев А.В., Чижиков А.А., Столбов А.П., Кривоносова О.А. Государственная регистрация программного обеспечения как медицинского изделия по правилам Евразийского экономического союза. Медицинские технологии. Оценка и выбор. 2023; 2: 32–49. doi: 10.17116/medtech20234502132
7. Васильев Ю.А., Владзимирский А.В., Омелянская О.В. и др. Методология тестирования и мониторинга программного обеспечения на основе технологий искусственного интеллекта для медицинской диагностики. Digital Diagnostics. 2023; 4(3): 252–267. doi: 10.17816/DD321971. EDN: UEDORU
8. Морозов С.П., Владзимирский А.В., Шарова Д.Е. и др. Первые национальные стандарты Российской Федерации на системы искусственного интеллекта в медицине. Менеджмент качества в медицине. 2022; 1: 58–62. EDN: XLBXVQ
9. Meskó B., Topol E.J. The imperative for regulatory oversight of large language models (or generative AI) in healthcare. NPJ Digit. Med. 2023; 6(1): 120. doi: 10.1038/s41746-023-00873-0.
Об авторах
А. В. ГусевРоссия
Александр Владимирович Гусев, канд. тех. наук, старший научный сотрудник
отдел научных основ организации здравоохранения
127254; ул. Добролюбова, д. 11; Москва
О. Р. Артемова
Россия
Олия Рашитовна Артемова, заместитель директора
департамент цифрового развития и информационных технологий
127994; Рахмановский пер, д. 3; Москва
А. Е. Андрейченко
Россия
Анна Евгеньевна Андрейченко, канд. физ.-мат. наук, руководитель направления
направление искусственного интеллекта
185031; набережная Варкауса, д. 17; Петрозаводск
И. В. Иванов
Россия
Игорь Владимирович Иванов, д-р мед. наук, генеральный директор
115478; Каширское шоссе, д. 24, стр. 16; Москва
Рецензия
Для цитирования:
Гусев А.В., Артемова О.Р., Андрейченко А.Е., Иванов И.В. Формирование рынка программных медицинских изделий в Российской Федерации в 2007–2024 гг.: практические результаты. Национальное здравоохранение. 2024;5(3):53-61. https://doi.org/10.47093/2713-069X.2024.5.3.53-61
For citation:
Gusev A.V., Artemova O.R., Andreychenko A.E., Ivanov I.V. Formation of the market of software medical devices in the Russian Federation in 2007–2024: Practical results. National Health Care (Russia). 2024;5(3):53-61. (In Russ.) https://doi.org/10.47093/2713-069X.2024.5.3.53-61























